本人承担一个关于辣椒耐涝的基础性研究项目,虽然经费只有15万,但是要完成华南地区辣椒品种的耐涝筛选,而后要利用RNA-Seq技术来进行反转录测序,进而找出在涝渍胁迫下,根据植株RNA表达的差异研究在涝渍胁迫下植株的那些基因参与了这个胁迫反应,如果能够找出相关耐涝方面的基因,就是找出那些在涝渍胁迫下表现为上调或者下调表达的基因,在已经制定耐涝QTL物理图谱的基础上,那么我们就可以定位到具体的染色体上。这是以后进行转基因研究和品种改良的基础。
做这个项目最基本也是最重要的工作其实是在第一步,就是品种的筛选。我们必须找出筛选耐涝辣椒植株的方法和对涝害敏感与耐涝的品种。经过一年的摸索,我们已经找到筛选这种耐涝辣椒植株的方法,并且获得了2个耐涝品种和多个敏感品种,不可否认,大部分的辣椒植株是无法承受涝渍胁迫的,表现为黄叶,叶片卷曲、白化甚至脱落,植株基本停止长高。
等结果出来后,再详细报告记录这个过程。今天主要分享一篇读书报告《水浸后期玉米幼苗根部转录组的识别》,这是一篇由武汉华中农业大学的作物遗传改良国家重点实验室郑用琏教授研究团队2010年发表于BMC Plant Biology的文章。BMC Plant Biology是一个开放阅读期刊,在植物学及相关领域如园艺学、农学具有较高知名度,SCI影响因子约为3.8。

一,研究背景
由洪涝、长时间雨水和排水不良引起的涝渍危害是一个世界范围内对粮食产量产生严重影响的非生物胁迫。
氧气的缺乏是涝渍危害的一个主要特点,因为在水中氧气的扩散速度是空气中的10-4。这种氧气在水中扩散缓慢和植物根系快速吸收的不平衡导致了根部氧气供应的急剧减少。u
植物是通过基因转录和翻译的特定变化来响应缺氧环境,首次是在玉米根部开展植物根系对缺氧环境响应的研究。
在多年来的研究中,许多为适应这种缺氧环境而发生变化的基因已经被识别,一般而言可以分为4类。1,传感和细胞信号传导基因,2,调节新陈代谢基因,3,维持PH平衡基因,4,其它基因,包括非类生血红蛋白等。
理论上,涝渍可以分为3个阶段。
1,0-4 h:信号转导组件的快速诱导
2,4-24 h:新陈代谢适应,包括糖酵解和氮代谢途径 的诱导
3,24-48 h:通气组织的形成,木葡聚糖内糖基转移酶 的诱导及细胞程序性死亡等
Qiu从耐涝自交系HZ32中识别了34个耐涝QTL,大部分QTL分布于染色体4和染色体9,少数分布于染色体1,2,3,6,7,10。
二,研究方法
与水稻、拟南芥及其它植物相比,对玉米耐涝的分子机制研究较少,并且这些转录组学和蛋白质组学方面的耐涝研究主要集中于涝渍危害开始的前期阶段(0-8h) ,而对后期(12h后)的反应研究较少。本实验拟对玉米幼苗水浸后期的转录组学进行研究。
植物材料和生长条件: 耐涝自交系HZ32的种子催芽3天,之后移植到沙盆培养。白天和黑夜的时间分配是16:8h,温度比值为30:22℃。3片叶时,开始进行胁迫处理,挑选长势一致的苗为两组,一组正常浇水作为对照,另外一组用水淹没根部进行水浸处理。
RNA提取: 分别处理12h,16h,20h,24h后进行采样,8棵苗作为一个样本,储存于-70℃冰箱。在各个时间点同时采集对照样本。使用TRIzol法提取总RNA,用琼脂糖凝胶电泳和Nanodrop分光光度计评估RNA质量和数量。
SSH文库构建: 从4个时间点中取等量250ug总NRA混合后取2ug作为Tester,从相应的对照中也取等量RNA作为Driver,使用PCR-select cDNA subtraction Kit试剂盒进行SSH处理。
序列分析
对大于100bp的EST序列进行分析。
使用Phred-Phrap分析软件去掉接头序列和载体序列,
使用DNAstar进行去除重复序列。
使用BLAST进行相似性搜索
用Gene Ontology对EST进行功能分类。
实时定量PCR检测:
准备3份总RNA进行qRT-PCR。使用RNase-free DNase进行5’ 降解。用M-MLV RTase cDNA Synthesis Kit进行总RNA逆转录,使用PRIMER3 设计引物。
使用SYBRGreen PCR Master Mix对目标基因进行PCR扩增。引物actin的表达作为对照。
总共找到465个大于100 bp的EST标签。cDNA片段大小从104 to 1081 bp,平均约为332bp
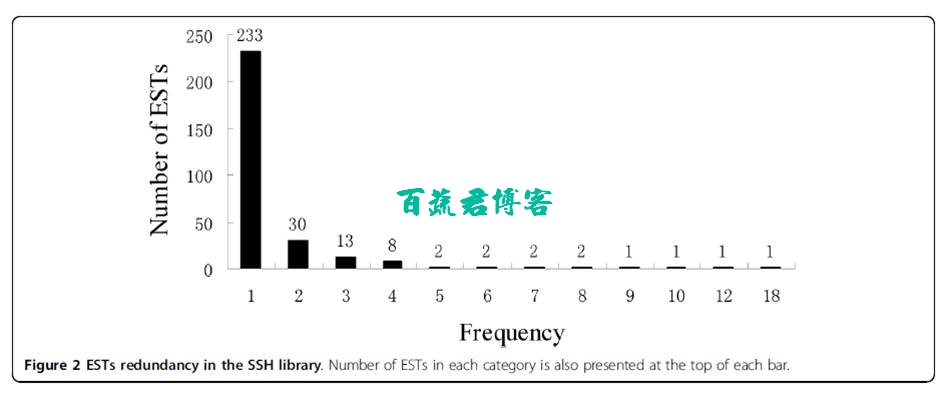
上调基因注释和功能分类:在465个EST标签中总共有296个unigene,其中233个是单序列,63个是连续序列。
上调基因注释和功能分类
最丰富的unigene包含了18个EST,主要编码核苷酸结合蛋白 。
第二丰富的unigene包含了13个重叠EST,编码应激逆境蛋白。
第三丰富的unigene包含10个EST,编码丙氨酸转氨酶
从这296个unigene在GenBank中的注释来看,在数据库中8.4%没有同源基因。这些没有同源基因unigene的平均长度明显比那些已注释基因的长度要短。
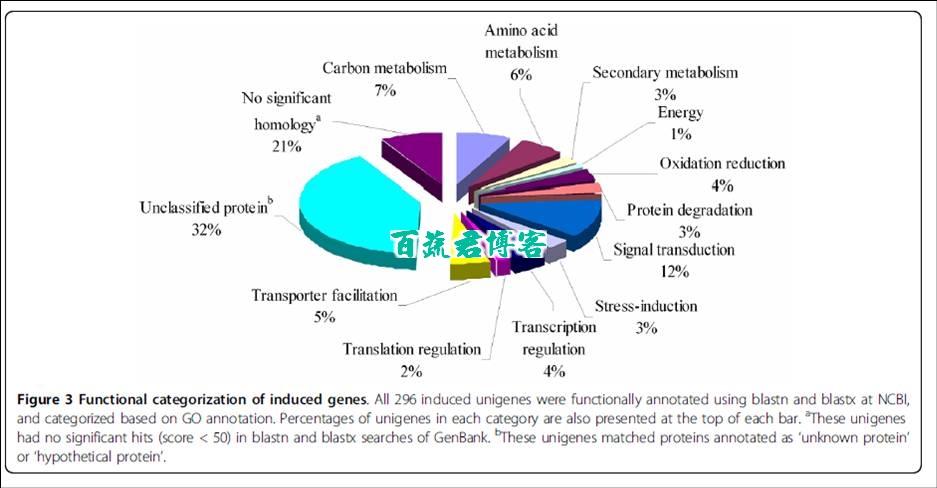
使用Gene Ontology将这296个基因分成13个功能目录
49.3%无法分类
水浸时表达上调的荷尔蒙信号关联基因大多来编码植物的荷尔蒙响应因子,比如生长素应答因子 ,乙烯响应蛋白等
已经确认小分子信号转导过程 在水胁迫下具有重要作用。在水浸后期一些编码小信号分子的基因也表达上调。
我们也检测到两个分别编码钙离子结合蛋白 和钙网蛋白的基因,这两个基因响应Ca2+的信号转导过程,这说明 Ca2+介导的信号级联存在被水浸影响的可能。
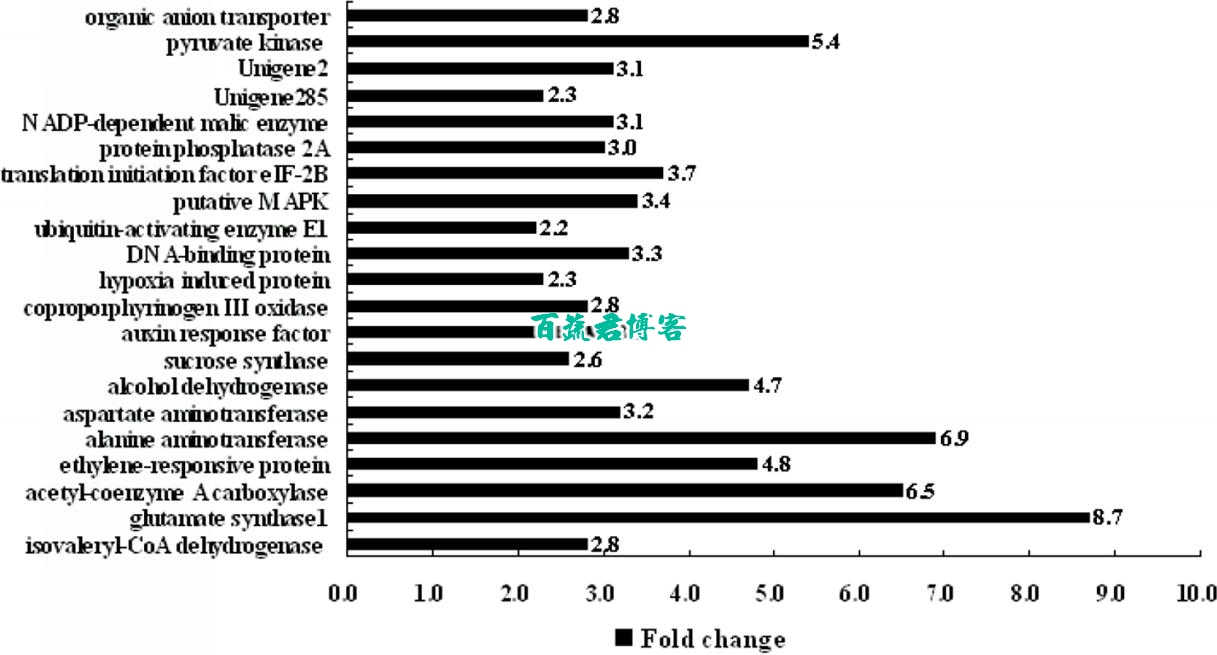
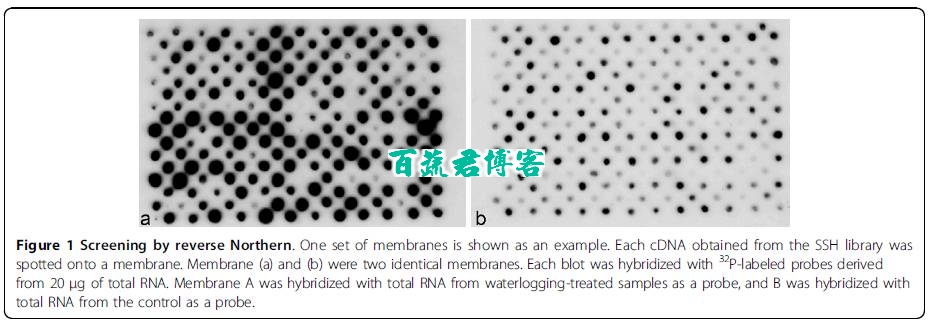
为了检验SSH文库数据,对21个unigene进行了转录水平的检测,结果表明与反向Northern杂交结果一样,这些unigene对于水浸胁迫呈现大于2倍的高表达量。
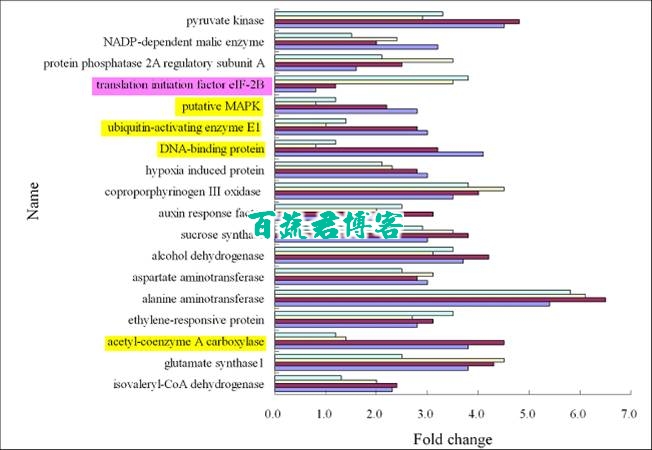
不是每一个基因在每一个时间点都是上调表达。
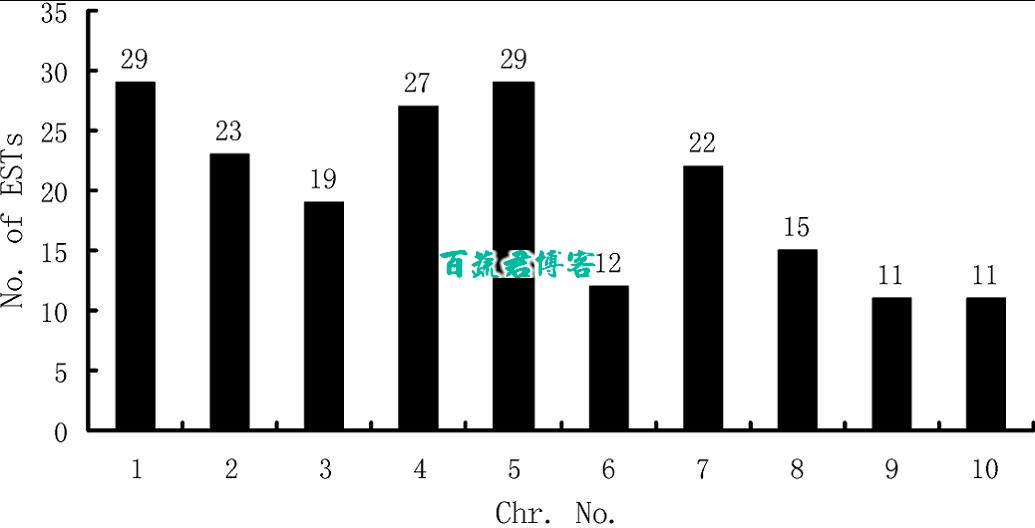
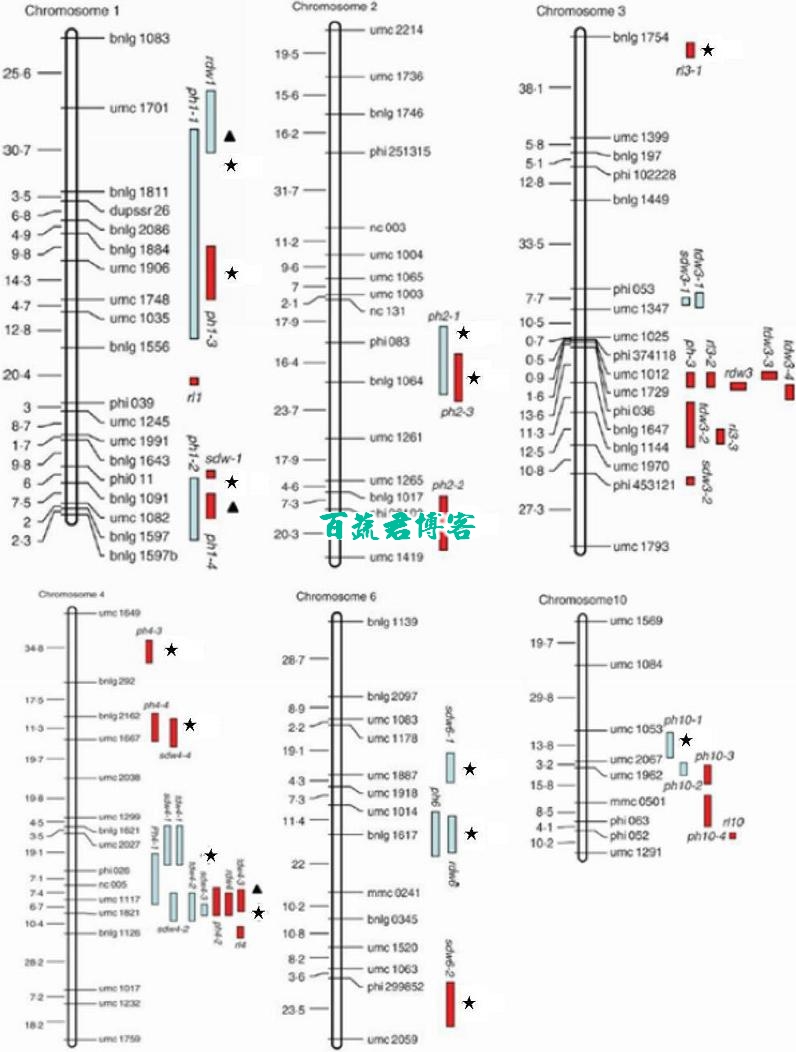
在以前的研究中,已经制定耐涝QTL物理图谱。这就允许我们判断本次试验检测到的这些unigene是否位于这些QTL区域内。使用blastn软件,198个unigene定位到玉米物理图谱中。
QTL定位:
u黑色的星星表明多个EST被分配到单个位点;黑色的三角形表明单个EST被分配到单个位点.
u63个基因(21.1%)被映射到包含多个或者单个特征的QTL区域。
u共位基因主要位于染色体1,2,3,4,6,10.其中超过60%是位于染色体1和4。
—————————————————————————————————————
这篇文章有几个很重要的前提条件和特点:
第一个就是已经拥有了耐涝自交系,也就是有了材料,但是没有办法知道她这个耐涝自交系是怎样筛选的,判断标准或者评价体系是什么。
第二个,由于是2010年发表,做这个试验较早,运用了构建SSH文库,反向Northen筛选等技术,现在的话应当可以直接应用RNA-Seq大通量测序技术,就可以找出表达上调与下调的基因,试验应当没有这么麻烦与繁琐。
第三个,最后的物理图谱定位,是因为在以前的研究中,已经做出了玉米耐涝QTL物理图谱,这也是在这里能够定位的一个基础条件。
不由得想说,协同作战和试验室累积基础很重要啊,高新技术对科研的重要性不言而喻。日新月异高速发展的分子技术为科学研究提供了更多高效、准确、省时省力的选择,我们也无时无刻不在进步!几个月或者半年没有关注最新科学前沿,或许你就不会做科研了,O(∩_∩)O哈哈~
转载请注明:百蔬君 » 【原创文章】读书报告:水浸后期玉米幼苗根部转录组的识别